ALCOHOLES Y FENOLES
ALCOHOLES Y FENOLES
MARÍA ALEJANDRA CALDERÓN PINZÓN
GRADO: 11-1
INSTITUCIÓN EDUCATIVA TÉCNICA
EXALUMNAS DE LA PRESENTACIÓN
IBAGUÉ
2019
INTRODUCCIÓN
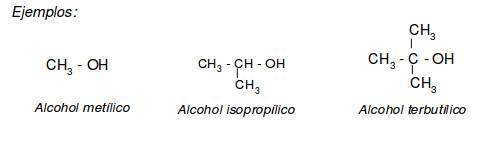
En este blog hablaremos sobre los alcoholes y fenoles, vamos a hablar de cada uno de estos; específicamente que son, propiedades, entre otras cosas. Para entender mejor estos temas utilizaremos unos ejercicios de formulación, de una página de química.
Si quieren practicar al final dejare el link de la página para que los puedan realizar por su cuenta.
Espero que la información dada aquí les sirva para entender mejor estos dos temas, anteriormente nombrados.
MARCO TEÓRICO
ALCOHOLES:
Los alcoholes son un grupo de moléculas orgánicas caracterizadas por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
La palabra Alcohol proviene del árabe al Kuhul que significa sutil. Sin embargo no se conoce con precisión cuando se usó por primera vez aunque se cree que es la droga más antigua y más usada del mundo.
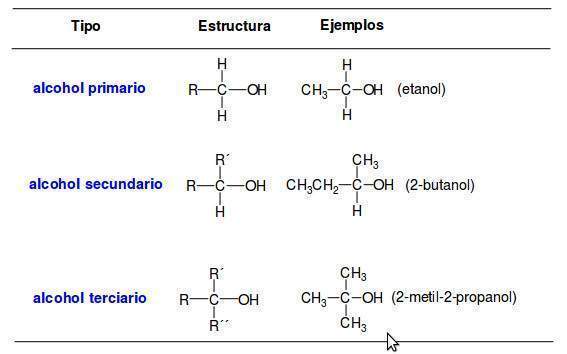
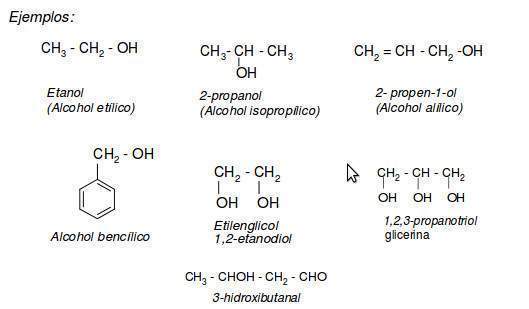
Clasificación:
Una manera de organizar la familia de los alcoholes es clasificar a los alcoholes en primarios, secundarios o terciarios de acuerdo con el tipo de átomos de carbono enlazados al grupo OH. En la siguiente tabla se indican las estructuras de los alcoholes según su grado de sustitución:

Nomenclatura:
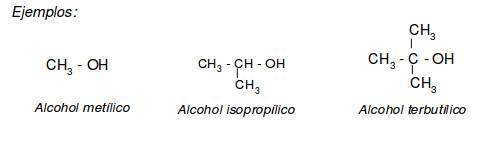
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
- Se busca la cadena más larga que incluya el Grupo Hidroxilo. La terminación o del hidrocarburo se cambia por -ol.
- La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay más de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
- Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador.

Propiedades:
En cuanto a sus propiedades, los alcoholes de baja masa molecular, están a temperatura ambiente en estado líquido y son incoloros, además de solubles en agua en mayor o menor medida.
A medida que aumenta el tamaño de la molécula también aumenta su punto de fusión y baja su solubilidad en el agua, llegando a poder estar en algunos casos en estado solido a temperatura ambiente. Aunque la mayoría de alcoholes tienen una densidad menor que la del agua, algunos, especialmente los que cuentan con anillos aromáticos, poseen una densidad mayor. La polaridad de los grupos -OH permite a estas moléculas establecer enlaces puente de hidrógeno con moléculas compañeras, o con aniones.
Aplicaciones:
El etanol se utiliza ampliamente en muchos sectores industriales y en el sector farmacéutico, como excipiente de algunos medicamentos y cosméticos (es el caso del alcohol antiséptico 70º GL y en la elaboración de ambientadores y perfumes). Es muy utilizado con fines culinarios (bebida alcohólica).
Es un buen disolvente, y puede utilizarse como anticongelante. También es un desinfectante. Su mayor potencial bactericida se obtiene a una concentración de aproximadamente el 70%.
La industria química lo utiliza como compuesto de partida en la síntesis de diversos productos, como el acetato de etilo (un disolvente para pegamentos, pinturas, etc.), el éter dietílico y otros. También se aprovechan sus propiedades desinfectantes. Se emplea como combustible industrial y doméstico. En el uso doméstico se emplea el alcohol de quemar. Este además contiene compuestos como la promovidos exclusivamente a alcohol. Esta última aplicación se extiende también cada vez más en otros países para cumplir con el protocolo de Kyoto. Estudios del Departamento de Energía de USA dicen que el uso en automóviles reduce la producción de Gases de Efecto de Invernadero en un 85%. En países como México existe la política del ejecutivo federal de apoyar los proyectos para la producción integral de etanol y reducir la importación de gasolinas que ya alcanza el 60%.
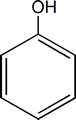
FENOLES:
Son compuestos que resultan de reemplazar un hidrógeno o más de su anillo aromático por uno o más OH.
El miembro más simple e importante de esta familia es el hidroxibenceno o Fenol.

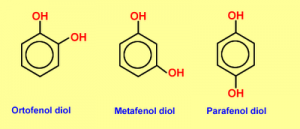
Si existen 2, 3 o más grupos OH se denominan difenoles, trifenoles o polifenoles respectivamente. Cuando los sustituyentes del anillo están vecinos se los llama con el prefijo orto (o). Si hay un lugar de separación entre ellos es meta (m) y si están en lados opuestos para (p).

El fenol no existe en estado libre.
Propiedades:
Es un sólido que cristaliza como agujas incoloras de olor particular. Su temperatura de fusión es de 38°C y su punto de ebullición de 181°C. es higroscópico, es decir, absorbe mucha agua.
Se puede oxidar ante la luz adquiriendo una coloración rosada. Es cáustico.
Es poco soluble en agua. Muy soluble en éter y alcohol.
Químicamente se comporta como ácido débil. Produce por lo tanto iones hidrógeno al disociarse.
Con respecto a las reacciones, hay de dos tipos. Las que se relacionan con el grupo OH y aquellas en las que participa el anillo.
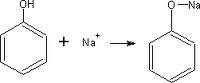
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.

Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
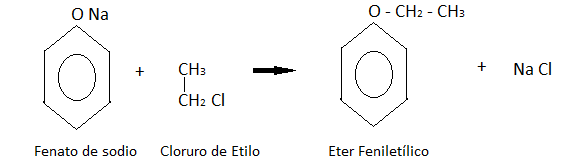
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.

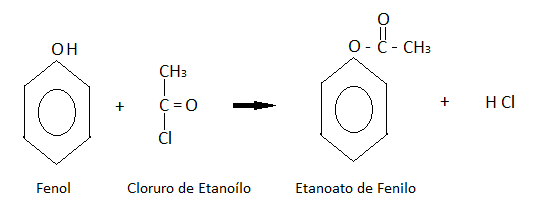
Formación de ésteres:
El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.

Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales.
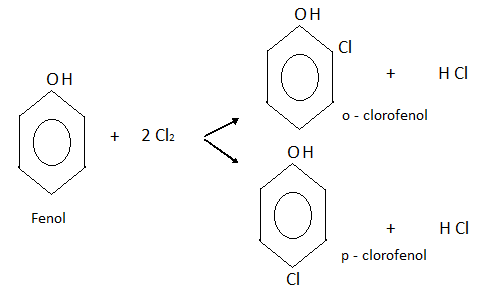
Halogenación:
Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.

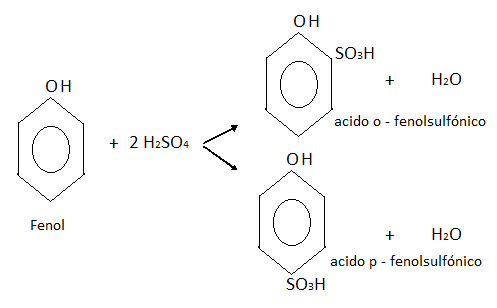
Sulfonación:
El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.

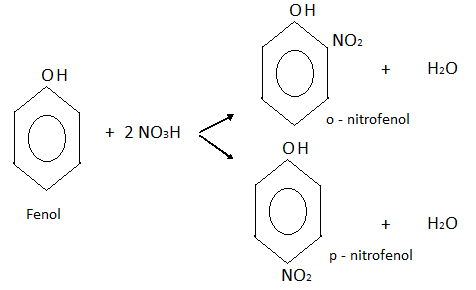
Nitración:
En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.

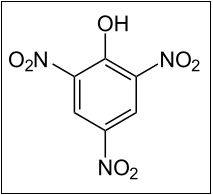
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.

PANTALLAZOS:
ALCOHOLES 1:
ALCOHOLES 2:
FENOLES 1:
FENOLES 2:
WEBGRAFÍA:
Link de la pagina de ejercicios:

BUEN TRABAJO 5,0
ResponderEliminar