Laboratorio Química Inorgánica
Química Inorgánica
María Alejandra Calderón Pinzón
Grado:10-1
Institución Educativa
Exalumnas de la Presentación
Ibagué
2018
Introducción:
En el trabajo que verán a continuación se hablara sobre la química, específicamente de la Neutralización, el pH e indicadores, y la titulación; de cada uno de los nombrados anteriormente daremos la definición, pondremos unos pantallazos de Yenga, en los que podremos observar y entender mejor de lo que estamos hablando.
Objetivos:
- Tener claro la definición de de la Neutralización, el pH y la circulación.
- Entender los indicadores de pH.
- Saber utilizar las escalas del pH.
Marco Teórico:
Neutralización: Es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua. La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo catión provenga de un ácido (Cl- del HCl). Las reacciones de neutralización son generalmente exótermicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.

pH: Es una medida de acidez o alcalinidad de una disolución. El pH indica la concentración de iones de hidrógeno presente en determinadas disoluciones. La sigla significa potencial de hidrógeno o potencial de hidrogeniones.
El término pH se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar empleando la concentración molar del ion hidrógeno.
En disolución acuosa, la escala de pH varía, típicamente, de 0 a 14. Son ácidas las disoluciones con pH menores de 7 (el valor del exponente de la concentración es mayor, porque hay más iones hidrógeno en la disolución). Por otro lado, las disoluciones alcalinas tienen un pH superior a 7. La disolución se considera neutra cuando su pH es igual a 7, por ejemplo el agua.
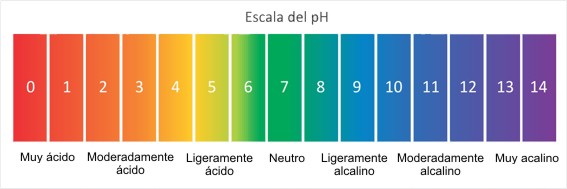
- Fenolftaleína: De fórmula C20H14O4, es un indicador de pH que en disoluciones ácidas permanece incoloro, pero en disoluciones básicas toma un color rosado con un punto de viraje entre pH: 8-2, (incoloro) y pH: 10 (magenta o rosado). Es un compuesto químico orgánico que se obtiene por reacción del fenol (C6H5OH) y el anhídrido ftálico (C8H4O3) en presencia de ácido sulfúrico.
- Universal: Es un indicador de pH hecho de una solución de varios compuestos que exhibe varios cambios de color suaves en un amplio rango de valores de pH para indicar la acidez o la alcalinidad de las soluciones. Aunque hay varios indicadores universales de pH disponibles en mercados, la mayoría es una variación de una fórmula patentada por Yamada también se describen en el Journal of Chemical Education. Un indicador universal está compuesto típicamente de agua, propan-1-ol, fenolftaleína sódica sal, hidróxido de sodio, rojo de metilo, bromotimol azul sal monosódica y timol azul sal monosódica.
- Tornasol: Es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un indice de pH de 4,5 (de ahí su nombre) y oscurece solo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y la fenolftaleína.
Un reactivo llamado "titulador" , de volumen y concentración conocida (una solución estándar o solución patrón) se utiliza para que reaccione con una solución del analito, de concentración desconocida. Utilizando una bureta calibrada para añadir el valorante es posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final. El punto final es el punto en el que finaliza la valoración, y se determinara mediante el uso de un indicador. Idealmente es el mismo volumen que en el punto de equivalencia-el número de moles de valorante añadido es igual al número de moles de analito, algún múltiplo del mismo. En la valoración clásica ácido fuerte-base fuerte, el punto final de la valoración es el punto en el que el pH del reactante es exactamente 7, y a menudo la solución cambia en este momento de color de forma permanente debido a un indicador. sin embargo, existen muchos tipos diferentes de valoración. Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales. En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. No todas las titulaciones requieren un indicador. En algunos, o bien los reactivos o los productos son fuertemente coloreados y pueden servir como "indicador". Después del punto de equivalencia, hay un exceso de la disolución titulante (permanganato) y persiste un color rosado débil que no desaparece.
Marco de Desarrollo:
Neutralización:


- Entramos a yenka.
- Seleccionamos Química inorgánica.
- Escogemos ácidos, bases y sales.
- Elegimos neutralización.
5. Combinamos en el recipiente ácido nítrico y hidróxido de potasio, y esto nos da como resultado agua y nitrato de potasio.
7. Se combina ion sulfato más ion hidrógeno ácido sulfúrico más hidróxido de sodio da como resultado agua más sulfato de sodio.


8. Cuando se combina ácido clorhídrico más hidróxido de sodio el resultado es agua más cloruro de sodio.
pH e indicadores:
- Abrimos el pH e indicadores
- Comenzamos con la fenolftaleína
- Medida de la fenolftaleína pH
- Continuamos con el universal
- Escala del pH universal

- Terminamos el pH e indicadores con el tornasol
Escala del Tornasol 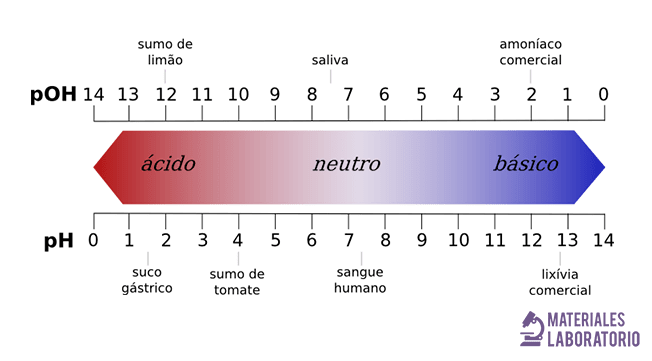




 Conclusión:
Conclusión:

Titulación:
- Abrimos la titulación
2. Añadimos Hidróxido de sodio
3. Colocamos Tornasol
4. Añadimos ácido clorhídrico
5. Y cuando se mezcla todo lo anterior, el pH es ácido ya que se encuentra entre 0-6
Con la realización de este laboratorio podemos entender y comprender mejor la química inorgánica, específicamente la neutralización, el pH e indicadores y, la titulación; ayudándonos con la herramienta de Yenga, ya que podemos divertirnos mientas obtenemos conocimientos que podemos llegar a necesitar más adelante.

FALTO CONSULTAR MAS MARCO TEORICO Y EJERCICIOS EN NEUTRALIZACION 4.0
ResponderEliminar