GRUPO 4, 5, 6 y 7
GRUPO 4, 5, 6 y 7
María Alejandra Calderón Pinzón
Grado: 11-1
Institución Educativa
Exalumnas de la presentación
Ibagué
2019
Introducción:
En este trabajo podrán encontrar información sobre los grupos 4, 5, 6 y 7 de la tabla periódica, explicaremos cada uno de estos grupos que son de Carbono, Nitrógeno, Oxigeno y Flúor; hablando de las características generales de cada uno de los grupos nombrados anteriormente.
Objetivos:
- Explicar las características del Carbono, Nitrógeno, Oxigeno y Flúor.
- Entender mejor la conformación de los grupos 4, 5, 6 y 7.
- Tener claros los conceptos básicos.
Grupo 4: Carbono
El grupo del Carbono es un grupo de la tabla periódica integrado por los elementos: Carbono (C), Silicio (Si), Germanio (Ge), Estaño (Sn), Plomo (Pb) En la notación moderna de la IUPAC se lo llama grupo 14. En el campo de la física de los semiconductores, todavía es universalmente llamado Grupo IV.
- Características:
- Propiedades químicas:
Al igual que otros grupos, los miembros de esta familia poseen similitudes en su configuración electrónica, ya que poseen la misma cantidad de electrones en el último nivel o subnivel de energía. Eso explica las similitudes en sus comportamientos químicos.
| Z | Elemento | Distribución electrónica/valencia |
|---|---|---|
| 6 | Carbono | 2, 4 |
| 14 | Silicio | 2, 8, 4 |
| 32 | Germanio | 2, 8, 18, 4 |
| 50 | Estaño | 2, 8, 18, 18, 4 |
| 82 | Plomo | 2, 8, 18, 32, 18, 4 |
Cada uno de los elementos de este grupo tiene 4 electrones en su capa más externa. En la mayoría de los casos, los elementos comparten sus electrones; la tendencia a perder electrones aumenta a medida que el tamaño del átomo aumenta. El Carbono es un no metal que forma iones negativos bajo forma de carburos (4-). El Silicio y el Germanio son metaloides con números de oxidación +4. El Estaño y el Plomo son metales que también tienen un estado de oxidación +2. El Carbono forma tetrahaluros con los halógenos. El Carbono se puede encontrar bajo la forma de tres óxidos: Dióxido de Carbono (CO2), Monóxido de Carbono (CO), y Dióxido de tricarbono (C3O2). El Carbono forma disulfuros y diselenios.
El Silicio forma dos hidruros: SiH4 y Si2H6. El Silicio forma tetrahaluros de Silicio con flúor, Cloro e Yodo. El Silicio también forma un dióxido y un disulfuro. La formula química del nitruro de Silicio es Si3n4.
El Germanio forma dos hidruros: GeH4 y Ge2H6. El Germanio también forma tetrahaluros con todos los halógenos, excepto con el Astato y forma dihaluros con todos los halógenos menos con el Bromo y el Astato. El Germanio también forma dióxidos, disulfuros y diselenios.
El estaño forma dos hidruros: SnH4 y Sn2H6. El Estaño forma tetrahaluros y dihaluros con todos los halógenos menos con el Astato.
El Plomo forma hidruros bajo la forma de PbH4. Forma dihaluros y tetrahaluros con el flúor y con el Cloro. También forma tetrabromuros y dihioduros.

- Propiedades físicas:
Los puntos de ebullición en el grupo del Carbono tienden a disminuir a medida que desciende en el grupo. El Carbono es el más ligero del grupo, el mismo sublima a 3825 grados centígrados. El punto de ebullición del Silicio es 3265 grados centígrados, el del Germanio es 2833 grados centígrados, el del Estaño es 2602 grados centígrados y el Plomo es 1749 grados centígrados. Los puntos de fusión tienen la misma tendencia que su ebullición. El punto de fusión del Silicio es 1414 grados centígrados, el del Germanio 939 grados centígrados, para el Estaño es 232 grados centígrados y para el Plomo 328 grados centígrados.
La estructura cristalina del Carbono es hexagonal, a altas presiones y temperaturas se encuentra bajo la forma de diamante.
La densidad de los elementos del grupo del Carbono tiende a aumentar con el aumento del número atómico. El Carbono tiene una densidad de 2,26 g/cm3, la densidad del Silicio es de 2,33 g/cm3 y la densidad del Germanio es de 5,32 g/cm3. el Estaño tiene una densidad de 7,26 g/cm3 mientras que la del Plomo es de 11,3 g/cm3.
El radio atómico de los elementos del grupo del Carbono tiende a aumentar a medida que aumenta el número atómico. El radio atómico del Carbono es de 77 picómetros, el del Silicio es de 118 picómetros, el del Germanio es de 123 picómetros, el del Estaño es de 141 picómetros, mientras que el del Plomo es de 175 picómetros.
- Alótropos:
El Silicio tiene dos alótropos, el amorfo y el cristalino. El alótropo amorfo es un polvo marrón, mientras que el cristalino es de color gris y tiene brillo metálico.
El Estaño tiene dos alótropos: α-estaño, también conocido como estaño gris, y β-estaño. El estaño se encuentra típicamente en la forma β-estaño. Sin embargo a presión normal el β-estaño se convierte a α-estaño, pasando de un metal plateado a un polvo gris, a temperaturas inferiores a los 56º Fahrenheit. Esto puede hacer que los objetos de estaño a temperaturas bajas se desmoronen en un proceso conocido como "la pudrición del estaño".
- Núcleo atómico:
- Isótopos:
Existen 15 isótopos conocidos de carbono. De ellos, tres son de origen natural. El más común de todos ellos es el carbono-12 estable, seguido por el carbono-13 estable. El carbono-14 es un isótopo radiactivo natural con una vida media de 5.730 años.
Se han descubierto 23 isótopos de silicio, cinco de ellos son de origen natural. El más común es de silicio-28 estable, seguido de silicio-29 estable y estable de silicio-30. Silicio-32 es un isótopo radiactivo que se produce naturalmente como un resultado de la desintegración radiactiva de los actínidos. Silicio-34 también se produce de forma natural como resultado de la desintegración radiactiva de los actínidos.
Hasta el momento se han descubierto 32 isótopos de Germanio, cinco de ellos son de origen natural. El más común es el isótopo estable de germanio-74, seguido por el isótopo estable de germanio-72, el isótopo estable de germanio-70, y el isótopo estable de germanio-73. El isótopo de germanio-76 es un radioisótopo.
Se han descubierto 40 isótopos de estaño, 14 de ellos se producen en la naturaleza. El más común es el isótopo estable estaño-120, seguido por el isótopo estable estaño-118, el isótopo estable estaño-116, el isótopo estable estaño-119, el isótopo estable estaño-117, el radioisótopo estaño-124, el isótopo estable estaño-122m el isótopo estable estaño-112 y el isótopo estable estaño-114. El estaño también tiene cuatro radioisótopos que se producen como resultado de la desintegración radiactiva de uranio. Estos isótopos son el estaño-121, estaño-123, estaño-125, y el estaño-126.
Se han descubierto 38 isótopos de plomo, 9 de ellos son de origen natural. El isótopo más común es el radioisótopo plomo-208, seguido por el plomo-206, el radioisótopo plomo-207, y el radioisótopo plomo-204. Cuatro isótopos de plomo se producen a partir de la desintegración radiactiva del uranio y el torio. Estos isótopos son el plomo-209, el plomo-210, el plomo-211 y plomo-212.
2. Descubrimiento y usos en la antigüedad:
El carbono, estaño y plomo son algunos de los elementos bien conocidos en el mundo antiguo, junto con azufre, hierro, cobre, mercurio, plata y oro.
Carbono como elemento fue utilizado por el primer ser humano para manejar carbón de un incendio.
El Silicio como sílice en forma de cristal de roca era familiar a los egipcios predinásticos, que lo utilizaron para los granos y pequeños jarrones. La fabricación de vidrio que contiene sílice se llevó a cabo tanto por los egipcios - al menos desde 1500 A.C - y por los fenicios. Muchos de los compuestos de origen natural o minerales de silicato fueron utilizados en diversos tipos de mortero para la construcción de viviendas.
Los orígenes de estaño parecen estar perdido en la historia. Parece que el bronce, que es una aleación de cobre y estaño, fue utilizado por el hombre prehistórico y algún tiempo antes se aisló el metal puro. Minas de estaño operaban tanto en la zonas aztecas de Sur y Centro América Inca y antes de la conquista española.
El plomo se menciona a menudo en relatos bíblicos. Los babilonios utilizaban el metal en forma de placas en los que grababan inscripciones. Los romanos lo utilizaron para las tabletas, tuberías de agua, monedas y utensilios de cocina; de hecho, como resultado de la última utilización, el envenenamiento por plomo fue reconocido en la época de Augusto César. El compuesto conocido como blanco de plomo aparentemente se preparó como un pigmento decorativo al menos desde 200 aC.
3. Aplicaciones:
El carbono es comúnmente utilizado en su forma amorfa. En esta forma el carbono se utiliza para la fabricación de acero, como relleno en los neumáticos, y como carbón activado. El carbono grafito se utiliza en los lápices. El diamante, otra de las formas del carbono, se utiliza comúnmente en la joyería. Las fibras de carbono se utilizan en numerosas aplicaciones, tales como puntales de satélite, debido a que las fibras son muy fuertes pero elásticas.
El dióxido de silicio tiene una amplia variedad de aplicaciones, incluyendo pasta de dientes,materiales de construcción, y la sílice es un uno de los componentes principales del vidrio. Un 50% del silicio puro se dedica a la fabricación de aleaciones de metales. Mientras que un 45% se dedica a la fabricación de siliconas. El silicio también se usa comúnmente en los semiconductores desde la década de 1950.
El germanio se utilizó en los semiconductores hasta la década de 1950, cuando fue sustituido por el silicio. Los detectores de radiación contienen germanio. El óxido de germanio se utiliza en la fibra óptica.
El uso más importante del estaño es en soldaduras; 50% de todo el estaño producido se destina a esta aplicación. Un 20% del estaño producido se utiliza en la hojalata. Otro 20% del estaño se utiliza en la industria química. El óxido de estaño (IV) se utiliza comúnmente en la cerámica desde hace miles de años.
Alguna de las aplicaciones del plomo son las pesas, pigmentos y como protección contra materiales radioactivos. El plomo fue utilizado históricamente en la gasolina en forma de tetraetilo de plomo, pero este uso se ha interrumpido debido a su alta toxicidad.
4. Producción:
Carbono en forma de diamante se produce sobre todo por parte de Rusia, Botswana, Congo, Canadá y Sudáfrica. Un 80% de todos los diamantes sintéticos son producidos por Rusia. China produce un 70% de grafito en el mundo. Otros países que producen grafito son Brasil, Canadá y México.
El silicio se puede producir por calentamiento de sílice con carbono.
En Rusia y China, el germanio también se separa de los yacimientos de carbón. Minerales que contienen germanio son tratados primero con el cloro para formar tetraclururo de germanio, que se mezcla con el gas hidrógeno.
China, Indonesia, Perú, Bolivia y Brasil son los principales productores de estaño. El método por el cual se produce estaño es al frente de la caserita mineral de estaño (SnO2) con coque.
El mineral de plomo más extraído es la galena (sulfuro de plomo). 4 millones de toneladas métricas de plomo se extraen cada año, la mayoría en China, Australia, Estados unidos y perú. La cantidad total de plomo nunca minada por los humanos es aproximadamente de 350 millones de toneladas métricas.
Grupo 5: Nitrógeno
El grupo 15 o el grupo V de la tabla periódica es también llamado como la familia del nitrógeno o los nitrogenoideos.

El grupo 15 está formado por los siguientes elementos: nitrógeno (N), fósforo (P), arsénico (As), antimonio (Sb), bismuto (Bi) y el elemento sintético moscovium (Mc). Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
1. Propiedades físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta a medida que se desciende en el mismo.
El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro. Por su parte, el fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades. Los más comunes son el fósforo blanco el más tóxico e inflamable, el fósforo rojo es mucho más estable y menos volátil y por último el fósforo negro, el cual presenta una estructura similar al grafito y conduce la electricidad. Además es más denso que las otras dos formas y no se inflama.

Los metaloides o semimetales de este grupo son el arsénico y antimonio. Estos elementos se asemejan a los metales en sus propiedades físicas, pero se comportan químicamente como un no metal. El arsénico es metaloide sólido y tóxico de color gris metálico que presenta tres formas alotrópicas:
El arsénico gris metálico: es la forma más estable de las tres y es un buen conductor del calor pero bastante malo conductor de electricidad.
El arsénico amarillo: Es enormemente volátil y más reactivo que el arsénico gris metálico y manifiesta fosforescencia a temperatura ambiente.
El arsénico negro: Presenta propiedades intermedias entre las formas anteriores.
De igual manera, el antimonio es un semimetal que en su forma elemental es un sólido cristalino de color blanco plateado, fundible, frágil, con una escasa conductividad de calor y electricidad que se evapora a bajas temperaturas. Este metaloide presenta cuatro formas alotrópicas:
Antimonio puro gris plateado
Antimonio blanco azulado: es su forma más estable y metálica
Antimonio negro: Inestable y no metálico
Antimonio amarillo: Inestable y no metálico
El elemento metálico de este grupo es el bismuto, el cual es cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio.
De manera resumida, las propiedades metálicas de este grupo van incrementando a medida que se desciende en la tabla periódica, desde el nitrógeno al bismuto. Por lo que ocurre una disminución de los puntos de fusión a partir del arsénico, ya que disminuye el carácter covalente de los enlaces y aumenta el carácter metálico.
2. Propiedades químicas:
Los elementos del grupo 15 poseen algunas propiedades químicas similares, entre estas tenemos:
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismita y bismutina entre otros compuestos.
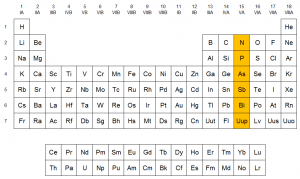
Ubicación de los elementos en la tabla periódica
3. Usos y aplicaciones de los elementos del grupo 15:
- Nitrógeno:
El nitrógeno es un gas diatómico que presenta una gran cantidad de aplicaciones industriales.
El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles. Aunque, en los automóviles comerciales es usual emplear aire normal.

También se pueden inflar neumáticos con
nitrógeno gaseoso
El gas nitrógeno se utiliza como un gas aislador, cuando se seca y se presuriza, para equipos de alta tensión.
El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.
4. Entre otros usos del gas nitrógeno tenemos:
- En la fabricación de piezas eléctricas tales como transistores, diodos y circuitos integrados.
- En la elaboración de acero inoxidable.
- Para disminuir el peligro de incendio en los sistemas militares de combustible de aeronaves.
- Se emplea como una alternativa al dióxido de carbono en la presurización de cerveza.
- En la industria alimentaria se emplea para conservar los alimentos envasados al interrumpir la oxidación de los mismos. Por ejemplo, para inflar los envoltorios que contienen alimentos, como los de frituras, y así mantenerlos frescos más tiempo.
- En medicina el nitrógeno es un elemento importante de casi todas las drogas farmacológicas. El óxido nitroso comúnmente llamado “gas de la risa” se utiliza como un anestésico.
Por su parte, el nitrógeno en su forma líquida, es usado en gastronomía para cocinar al frío los alimentos. Con la técnica del nitrógeno líquido se puede acelerar la cocción para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro. También se utiliza en la preparación de helados.

El nitrógeno líquido se utiliza para la
preparación de cócteles.
En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.

De igual manera es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
- Fósforo:
Al igual que el nitrógeno, el fósforo presenta un sinfín de aplicaciones. De hecho el fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
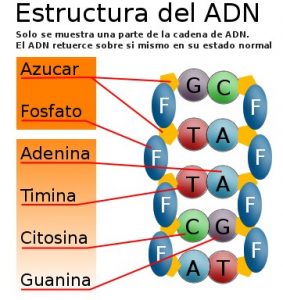
El fósforo en forma de fosfatos está
presente en el ADN
El fósforo rojo se emplea en la fabricación de cerillos, fósforos de seguridad, cohetes y en la elaboración de acero.

En su forma alotrópica blanca, es usado en bombas incendiarias, bombas de humo y en munición trazadora.
Los isótopos radiactivos de fósforo son utilizados en laboratorios como trazadores radiactivos para ayudar a comprender las reacciones e interacciones químicas.
Los compuestos de fósforo también son ampliamente utilizados, por ejemplo los fosfatos se emplean para fabricar un vidrio especial que se usa en las lámparas de sodio.
El tributilfosfato se emplea el proceso purex para extraer uranio.
El fosfato de calcio es usado para elaborar porcelana fina.
El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa. Sin embargo, se ha prohibido en otros países debido a que provoca la muerte de los peces cuando pasa hacia las vías fluviales.

Detergentes con fosfato
Otros compuestos de fósforo son empleados en la elaboración de pesticidas, fertilizantes, aditivos alimentarios y pasta dentales.
- Arsénico:
El arsénico en su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma. También se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.

Otro tipo de aleación es mezclado en pequeñas cantidades con el alfa latón para que sea más duro y resistente a la lixiviación de zinc. El alfa latón se emplea para elaborar piezas de tuberías u otros artículos que están en contacto constante con el agua.
Este metaloide es ampliamente usado en la fabricación de pesticidas, herbicidas e insecticidas, aunque actualmente se ha estado prohibiendo por su alta toxicidad.

Pesticidas, herbicidas e insecticidas
Debido a su toxicidad, es usado como conservante de madera y así evitar el contacto con insectos, bacterias y hongos.

El arsénico se usa como conservante de madera
En medicina fue usado en el tratamiento de algunas enfermedades como la sífilis, mucho antes del descubrimiento de la penicilina.
Actualmente es utilizado como aditivo en pequeñas cantidades en los alimentos de animales para prevenir enfermedades y ayudar a su desarrollo.
También se emplea en el tratamiento de un tipo de cáncer llamado leucemia promielocítica aguda.
Así mismo es empleado en la preparación de soluciones médicas de Fowler para el tratamiento de la psoriasis.
Por su parte, el isótopo arsénico-74 usa como una manera de ubicar tumores en el cuerpo. De hecho se origina imágenes más claras que empleando yodo.
- Antimonio:
El antimonio al igual que el arsénico, es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.

Láser
También es usado en aleaciones con otros elementos como por ejemplo, con estaño para obtener un metal antifricción; igualmente en el peltre, metal inglés, entre otros. De igual manera, se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza. Esta misma aleación es utilizada para elaborar piezas de imprenta.

Baterías de automóviles
Los compuestos de antimonio poseen una gran cantidad de aplicaciones industriales, dentro de los cuales se pueden nombrar:
- El trifluoruro de antimonio se utiliza para la fluoración
- El pentacloruro de antimonio se emplea en la cloración
- El tricloruro de antimonio se aprovecha como un catalizador para reacciones de polimerización, craqueo y en la cloración. También es un reactivo utilizado en la prueba de Carr-Price para determinar la vitamina A y otros carotenoides.
- El óxido de antimonio III es usado como retardante de la llama de plásticos, catalizador para fibras plásticas, pigmentos, fritas cerámicas y ciertos minerales.
- El doble tartrato de antimonio y potasio se utiliza en el campo de la medicina
- El sulfuro de antimonio rojo se emplea en equipos de seguridad y en el vulcanizado del caucho.
- El isótopo radiactivo Sb-124 se utiliza como trazador en los oleoductos.
- La mezcla de óxido y sulfuro de antimonio se usa como tinte amarillo para el vidrio y la cerámica.
- Bismuto:
Este metal es usado en aleaciones debido a que presentan baja temperatura de fusión por lo cual lo hace idóneo para ser empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.
Sus aleaciones también son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.
Las aleaciones de bismuto han tenido un auge comercial importante ya que se emplea como reemplazo del tóxico plomo.

Anillo de cristales de bismuto
Los compuestos de bismuto poseen una variedad de usos en cosméticos, por ejemplo el oxicloruro de bismuto, usualmente es empleado como pigmento en sombras de ojos, espray para el cabello y esmalte para uñas.

En el campo de la medicina es utilizado en la elaboración de varios medicamentos para el tratamiento de gripes, alergias y diarreas. El subsalicilato de bismuto es empleado para tratar la diarrea, acidez estomacal y malestar estomacal.

- Moscovium:
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades y conocerse muy poco sobre ellos, no posee uso comercial. Por lo tanto, es empleado en menor medida en la investigación científica.

Grupo 6: Oxígeno

El grupo 16 o grupo VI de la tabla periódica es también llamado como antígenos, calcógenos o la familia del oxígeno. El término anfígeno procede del griego y significa formador de ácidos y bases.
Por su parte, el término calcógeno proviene del griego y significa formador de minerales.
El grupo 16 está formado por los siguientes elementos: Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te), Polonio (Po) y el elemento sintético Livermorio (Lv).
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
1. Propiedades físicas:
Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio.
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando el ciclo del Azufre, que son cadenas Sn (n = 3-10), S2.

Elementos del grupo en estado elemental
El selenio es un metaloide que presenta, al igual que el azufre, varias formas alotrópicas. Primero el selenio rojo coloidal, el cual está compuesto por moléculas Se8. El selenio negro vítreo formado por anillos Sen con n muy grande y variable (forma amorfa) y por último el selenio gris cristalino de estructura hexagonal, la cual es la forma más común y análoga a la del azufre plástico. Este alótropo exhibe aspecto metálico, de hecho es un semimetal y es fotoconductor.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
2. Propiedades químicas:
Los elementos del grupo 16 ostentan algunas propiedades químicas similares, entre estas tenemos:
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve
- reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
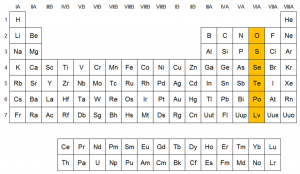
Ubicación de los elementos en la tabla
3. Usos y aplicaciones de los elementos del grupo 16:
- Oxígeno.
El oxígeno es uno de los elementos más importantes y por tal razón posee una gran cantidad de aplicaciones. Principalmente, es utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía. El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos. El envenenamiento por monóxido de carbono se trata también con oxígeno gaseoso.
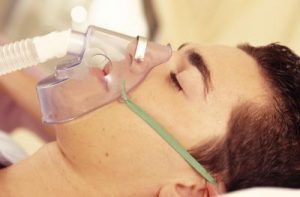
El alótropo ozono es empleado en una terapia denominada ozonoterapia para aliviar enfermedades como artritis, óseas, hepáticas y neurológicas entre otras. El ozono una vez introducido al organismo desencadena una serie de reacciones metabólicas positivas que ayudan a combatir a todos estos trastornos.

El oxígeno con un alto grado de pureza se emplea en los trajes espaciales para que los astronautas puedan respirar.

De igual manera, es usado en los tanques de buceo, no obstante, se suele combinar con aire normal. Los tanques de oxígeno son también utilizados frecuentemente en aviones y submarinos en caso de emergencias.

Igualmente, el oxígeno puro es usado para garantizar la combustión completa de los productos químicos.
Una gran cantidad del oxígeno producido para aplicaciones comerciales se emplea para convertir el mineral de hierro en acero.
Entre otros usos del oxígeno tenemos:
Para el tratamiento de agua
Cortar y soldar metales
Obtención de polímeros de poliéster y los anticongelantes. Los polímeros se usan para fabricar plástico y telas.
El oxígeno líquido es usado como comburente para el lanzamiento de cohetes espaciales, generalmente empleando RP-1 como combustible, en una mezcla llamada Kerolox.
- Azufre:
Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.

Pero la aplicación más destacada en el ámbito comercial de este elemento es en la obtención de ácido sulfúrico. El ácido sulfúrico es sumamente necesario para una gran cantidad de industrias. Este compuesto se emplea en la elaboración de fertilizantes, tratamiento de aguas residuales, baterías de plomo para vehículos, extracción de mineral, eliminación de óxido de hierro, producción de nylon y obtención de ácido clorhídrico.

El azufre se usa para vulcanizar caucho. La vulcanización es un proceso mediante el cual se calienta el caucho crudo en presencia de azufre, con la finalidad de tornarlo más duro y resistente al frío. El caucho vulcanizado se emplea para elaborar neumáticos para automóviles, mangueras, suelas de zapatos y discos de hockey sobre hielo.

Entre los compuestos de azufre más utilizados tenemos:
El sulfato de magnesio se emplea como laxante, en sales de baño y como un complemento de magnesio para las plantas.
El disulfuro de carbono se usa para elaborar celofán y rayón.
Los sulfitos se emplean para blanquear el papel y conservar la fruta.
- Selenio:
Anteriormente estudiamos las formas alotrópicas del selenio. Estas diferentes formas le permiten al selenio tener múltiples aplicaciones dependiendo del alótropo. Por ejemplo, el selenio gris conduce la electricidad, sin embargo su conductividad varía con la intensidad luminosa, es decir, es buen conductor en la luz que en la oscuridad. Por tal razón, se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco, entre otros.

LED de color azul
Por su parte, el selenio rojo o como seleniuro de sodio se emplea para proporcionar un color rojo carmesí al vidrio, barnices y esmaltes. También se puede usar para eliminar las tintas de color verde o amarillo ocasionados por otras impurezas durante el proceso de elaboración de vidrio.

La aleación selenio con el bismuto se utiliza para elaborar un latón sin plomo.
El compuesto sulfuro de selenio es un componente habitual en el champú anticaspa que elimina el hongo que origina la descamación del cuero cabelludo. Asimismo se puede destinar para tratar algunos problemas de la piel producidos por otros hongos.

- Telurio:
El telurio aleado con otros elementos es utilizado en la fabricación de discos compactos regrabables. La capa del CD-RW que contiene la información está constituida por una aleación cristalina de plata, indio, antimonio y telurio.

También se alea con cobre y plomo para mejorar la tenacidad y dureza a la hora de elaborar rectificadores y dispositivos termoeléctricos.
Al igual que el selenio, es utilizado para teñir el vidrio, en este caso de color azul.

El teluro coloidal se aprovecha para la preparación de insecticidas, germicidas y fungicidas.
Es usado como agente vulcanizador en el proceso de elaboración de caucho sintético y natural.
- Polonio:
Los isótopos del polonio son una excelente fuente de radiación alfa pura. Aleado con berilio, es una fuente de neutrones.

También se usa en dispositivos destinados a la ionización el aire para la eliminación de cargas electrostáticas en cepillos específicos para limpiar el polvo almacenado en películas fotográficas e impresiones.

Por su parte, el isótopo Po-210 se emplea como fuente ligera de calor para proveer energía a las células termoeléctricas de ciertos satélites artificiales y sondas lunares.
El Po-210 está presente en el humo de tabaco. Desde los años 60, las empresas de producción de tabaco se comprometieron a eliminar esta sustancia de sus productos pero no lo han logrado.

Livermorio.
Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en la investigación científica.

Grupo 7: Flúor
Los halógenos son los elementos químicos que forman el grupo 17 o grupo VII A de la tabla periódica: flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y téneso (Ts). Este último también está en los metales del bloque f.
En estado natural se encuentran como moléculas diatómicas químicamente activas [X2]. Para llenar por completo su último nivel energético (s2p5) necesitan un electrón más, por lo que tienen tendencia a formar un ion mononegativo, X-. Este ion se denomina haluro; las sales que lo contienen se conocen como haluros. Poseen una electronegatividad ≥ 2.5 según la escala de Pauling, presentando el flúor la mayor electronegatividad, y disminuyendo ésta al bajar en el grupo. Son elementos oxidantes (disminuyendo esta característica al bajar en el grupo), y el flúor es capaz de llevar a la mayor parte de los elementos al mayor estado de oxidación.
Muchos compuestos orgánicos sintéticos, y algunos naturales, contienen halógenos; a estos compuestos se les llama compuestos halogenados. La hormona tiroidea contiene átomos de yodo. Los cloruros tienen un papel importante en el funcionamiento del cerebro mediante la acción del neurotransmisor inhibidor de la transmisión GABA (ácido gamma-amino butírico).
Algunos compuestos presentan propiedades similares a las de los halógenos, por lo que reciben el nombre de pseudohalógenos. Puede existir el pseudohalogenuro, pero no el pseudohalógeno correspondiente. Algunos pseudohalogenuros: cianuro (CN-), tiocianato (SCN-), fulminato (CNO-), etcétera.
Los fenicios y los griegos de la antigüedad utilizaron la sal común para la conservación de alimentos, especialmente en la salazón del pescado.
1. Historia:
Etimológicamente, la palabra "halógeno" proviene del griego hals, 'sal' y genes, 'origen' (que origina sal). El nombre halógeno, o formador de sal, se refiere a la propiedad de cada uno de los halógenos de formar, con el sodio, una sal similar a la sal común (cloruro de sodio). Todos los miembros del grupo tienen una valencia de -1 y se combinan con los metales para formar halogenuros (también llamados haluros), así como con metales y no metales para formar iones complejos. Los cuatro primeros elementos del grupo reaccionan con facilidad con los hidrocarburos, obteniéndose los halogenuros de alquilo.
Los elementos halógenos son aquellos que ocupan el grupo 17 del Sistema Periódico. Las formas moleculares de los halógenos (diatómicas) F, Cl, Br, I y At, son elementos volátiles, cuyo color se intensifica al aumentar el número atómico. El flúor es un gas de color amarillo pálido, ligeramente más pesado que aire, corrosivo y de olor penetrante e irritante. El cloro es un gas amarillo verdoso de olor penetrante e irritante. El bromo a la temperatura ambiente es un líquido de color rojo oscuro, tres veces más denso que el agua, que se volatiliza con facilidad produciendo un vapor rojizo venenoso. El yodo es un sólido cristalino a temperatura ambiente, de color negro y brillante, que sublima dando un vapor violeta muy denso, venenoso, con un olor picante como el del cloro. El Astato es un elemento muy inestable que existe sólo en formas radiactivas de vida corta, y que aparece en el proceso de desintegración del 235U. En la Tabla 1 se muestran algunas de las propiedades físicas y atómicas de los elementos de este grupo.
Todos los átomos poseen una configuración que difiere de la de gas noble en un electrón, de forma que los elementos tienden a formar especies negativas, X¯, o a formar enlaces covalentes simples. La química de estos elementos y sus compuestos cambian con el tamaño de los mismos.
Como es esperable, los puntos de fusión y ebullición aumentan al descender en el grupo al contrario del derecho. Las energías de ionización de los halógenos presentan valores muy altos que van disminuyendo al aumentar el número atómico. Las afinidades electrónicas son elevadas como consecuencia de la tendencia a ganar un electrón y conseguir así la configuración de gas(es) noble(s).
2. Caracteristicas:
Los halógenos muestran tendencias en su energía de enlace de arriba abajo en la tabla periódica con fluoruro mostrando una desviación mínima. Muestran tener una energía de enlace fuerte con otros átomos pero interacciones débiles con la molécula diatómica de F2. Lo cual significa que a medida en que se desciende en la tabla periódica la reactividad del elemento disminuye por el aumento en el tamaño del átomo.
Los halógenos son altamente reactivos, por lo que pueden ser dañinos para organismos biológicos en suficientes cantidades. Su alta reactividad se debe a la alta electronegatividad que sus átomos presentan por sus cargas nucleares altamente efectivas. Los halógenos tienen 7 electrones de valencia en su capa de energía externa por lo que al reaccionar con otro elemento satisfacen la regla del octeto. Fluoruro es el más reactivo de los elementos, ataca a materiales inertes como el vidrio y forma compuestos con los gases nobles inertes. Es un gas corrosivo y altamente tóxico.
3. Compuestos:
Los halógenos forman moléculas diatómicas homonucleares (no comprobado con ástato). Debido a sus fuerzas intermoleculares relativamente débiles el cloro y el fluór forman parte del grupo de “gases elementales”.
Entre los compuestos formados por halógenos se encuentran los haluros de hidrógeno, haluros metálicos, interhalógenos.
4. Haluros de compuestos:
Todos los haluros de hidrógeno, HX, son gases a 298 K y tienen un olor ácido intenso. La combinación directa de H2 y X2 para formar HX solo puede utilizarse en la síntesis de cloruro y bromuro. El fluoruro de hidrógeno se prepara tratando los fluoruros adecuados con H2SO4 concentrado y las reacciones análogas preparan HCl. Las reacciones análogas con bromuros y yoduros tienen como resultado la oxidación parcial de HBr o HI a Br2 o I2 y así la síntesis tiene lugar con PX3 preparado in situ.
5. Haluros metálicos:
odos los haluros de metales alcalino tienen estructura NaCl o CsCl y su formación puede considerarse en términos del ciclo de Born- Haber. La reacción del sodio con cloruro es:
2Na + Cl2 → 2NaCl
En ausencia de disolvente, el cambio de energía asociado con la reacción implica:2
- La diferencia en términos de energía en enlace C-Cl y C-F (no depende de M)
- La diferencia entre la afinidad electrónica de F y Cl (no dependen de M)
- La diferencia de energía de red entre MF y MCl (que dependen de M)
La mayor parte de los difluorenos metálicos cristalizan con estructura CaF2 o de rutilio y para la mayoría de ellos es adecuado un modelo iónico simple.Los tricloruros metálicos son cristalograficamente más complejos que los difluoruros, pero normalmente se presentan en estructuras tridimensionales simétricas y muchos contienen centros metálicos octaédricos (a veces distorsionados). La mayor parte de los tetrahaluros metálicos son o bien especies volátiles (SnCl4 , TiCl4), o contienen anillos o cadenas con puentes M-F-M (SnF4); los puentes metal- halógenos son , as largos que los enlaces terminales.Los penta haluros metálicos pueden poseer estructuras de cadenas o anillos (NbF5) o estructuras moleculares (SbCl5) , mientras que los hexaluros son moleculares y octaedros (UF6, MoF6) . En general en aumento de oxidación tiene como resultado un cambio estructural a lo largo de la serie iónica tridimensional capas o polímero molecular.
6. Interhalógeno:
Un interhalógeno es un compuesto que contiene dos o más átomos de halógenos diferentes (flúor, cloro, bromo, yodo o ástato).
La mayoría de los interhalógenos conocidos son binarios (compuestos de dos elementos distintos). Su fórmula general es XYn, donde n = 1, 3, 5 ó 7, y X es el halógeno menos electronegativo. Todos ellos son propensos a la hidrólisis, y se ionizan para dar lugar a iones polihalogenados.
No hay compuestos interhalogenados que contengan tres o más halógenos diferentes que sean definitivamente conocidos, aunque algunos libros reclaman que IFCl2 y IF2Cl han sido sintetizados y estudios teóricos indican que algunos compuestos en la serie BrClFn son apenas estables.
- Tipos:
Los interhalógenos de la forma XY tiene propiedades físicas intermedias entre los dos halógenos que los componen. El enlace covalente entre los dos átomos tiene algo de carácter iónico. El halógeno menos electronegativo, X, está siendo oxidado y tiene una carga parcial positiva. Todas las combinaciones de fluór, cloro, bromo y yodo que tiene la fórmula general mencionada arriba son conocidos, pero no todos son estables. Algunas combinaciones de ástato con otros halógenos ni siquiera son conocidas y las que lo son, son altamente inestables.
- Monofluoruro de cloro (CIF) es el compuesto interhalógenado más ligero. CIF es un gas incoloro con un punto de ebullición normal de -100ºC.
- Monofluoruro de bromo (BrF) no ha sido obtenido como un compuesto puro, se disocia en trifluoruro y bromo libre. Se sintetiza de acuerdo a la siguiente reacción Br2(l) + F2(g) → 2BrF(g)
- Monofluoruro de yodo (IF) es inestable y se descompone a 0ºC, se desproporciona en yodo elemental y pentafluoruro de yodo.
- Monocloruro de bromo (BrCl) es un gas rojo-café con un punto de ebullición de 5ºC.
- Monocloruro de yodo (ICl) existe como cristales rojos transparentes que se derriten a 27.2ºC para formar un líquido café (similar en apariencia y peso la bromo). Reacciona con HCl para formar un ácido fuerte HICl2. La estructura cristalina de ICl consiste en cadenas fruncidas en zigzag, con fuertes interacciones entre ellas.
- Monocloruro de ástato (AtCl) está hecho por la combinación directa de ástato en fase gaseosa con cloro o por la adición sucesiva de ástato del ion dicromato a una solución de ácida de cloruro.
- Monobromuro de yodo (IBr) es sintetizado por la combinación directa de los elementos para formar cristales sólidos rojos oscuro. Se derrite a 42ºC y ebulle a 116ºC para formar un vapor parcialmente disociado.
- Monobromuro de ástato (At Br) se obtiene por la combinación directa de ástato con vapor de bromo o con una solución acuosa de monobromuro de yodo.
- Monoyoduro de ástato (AtI) es sintetizado por la combinación directa de ástato y yodo. Es el compuesto interhalógeno conocido más pesado.
El fluoruro de ástato no ha sido descubierto aún. Su ausencia se ha atribuido a la reactividad extrema de estos compuestos, incluyendo la reacción de flúor inicialmente formado en las paredes de un contenedor de vidrio para formar un producto no volátil. Aunque se piensa que la síntesis del compuesto es posible, puede requerir un solvente líquido de flúor.
Intehalógeno tetratómico:
- Trifluoruro de cloro es un gas incoloro que se condensa a un líquido verde y en sólido es blanco. Se obtiene al reaccionar cloro con un exceso de flúor a 250ºC en un tubo de níquel. Reacciona más violentamente que el flúor y es explosivo. La molécula es plana y en forma de T. Se utiliza para manufacturar hexafluoruro de uranio.
- Trifluoruro de bromo (BrF3) es un líquido amarillo-verde que conduce electricidad. Se ioniza para formar [BrF2]+ + [BrF4]−.
- Trifluoruro de yodo (IF3) es un sólido amarillo que se descompone arriba de -28ºC. Se puede sintetizar a partir de sus elementos, pero se debe tener cuidado para prevenir la formación de IF5. F2 ataca al I2 para formar IF3 a −45 °C en CCl3F. A bajas temperaturas la reacción I2 + 3XeF2 → 2IF3 + 3Xe se puede utilizar. Es un compuesto muy inestable.
- Tricloruro de yodo (ICl3) forma cristales amarillo limón que se derriten bajo presión a un líquido café. Se puede obtener de sus elementos a bajas temperaturas, o de pentóxido de yodo y cloruro de hidrógeno. Reacciona con varios metales para formar tetracloroyoduros y se hidroliza en agua. La molécula es un dímero plano (ICl3)2, con cada yodo alrededor de los cuatro cloros.
- Pentafluoruro de cloro (ClF5) es un gas incoloro, hecho al reaccionar trifluoruro de cloro con flúor a altas temperaturas y presiones. Reacciona violentamente con agua, con la mayoría de los metales y con los no metales.
- Pentafluoruro de bromo (BrF5) es un líquido incoloro sintetizado al reaccionar trifluroruo de bromo con flúor a 200ºC. Es físicamente estable pero reacciona violentamente con agua, con la mayoría de los metales y con los no metales.
- Pentafluoruro de yodo (IF5) es un líquido sintetizado al reaccionar pentóxido de yodo con flúor o yodo con plata (II). Es altamente reactivo, reacciona con elementos, óxidos y haluros de carbono. La molécula tiene una forma de pirámide tetragonal.
- Pentabromuro de yodo (IBr5) si existe (hay controversia en este punto), es un líquido rojo-café oscuro o un sólido café-amarillo incoloro, hecho al reaccionar yodo con bromo a 60ºC. En su estado líquido las mayoría de sus propiedades son parecidas al bromo, en cualquier estado, es muy tóxico. Es inestable al calentarlo arriba del punto de ebullición del bromo.
- Heptafluoruro de yodo (IF7) es un gas incoloro y un fuerte agente fluorizante. Es sintetizado al reaccionar pentafluoruro de yodo con flúor gaseoso. La molécula es una pirámide pentagonal. Este compuesto es el único interhalógeno conocido en donde el átomo más grande se enlaza con siete átomos de menor tamaño.
Todos los intentos para sintetizar heptafluoruro de bromo han fallado, en su lugar, se produce pentafluoruro de bromo y flúor en estado gaseoso.
7. Aplicaciones en general más importantes de los halógenos:
Aparte de las ya citadas lámparas halógenas, existen muchas otras aplicaciones de los halógenos.
Los derivados del flúor tienen una notable importancia en el ámbito de la industria. Entre ellos destacan los hidrocarburos fluorados, como el anticongelante freón y la resina teflón, lubricante de notables propiedades mecánicas.
El cloro encuentra su principal aplicación como agente de blanqueo en las industrias papelera y textil. Así mismo, se emplea en la esterilización del agua potable y de las piscinas, y en las industrias de colorantes, medicamentos y desinfectantes.
Los bromuros actúan médicamente como sedantes, y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas. El yodo, cuya presencia en el organismo humano resulta esencial y cuyo defecto produce bocio, se emplea como antiséptico en caso de heridas y quemaduras.
8. Moléculas halógenas diatómicas:
| Halógeno | Molécula | Estructura | Modelo | d(X−X) / pm (fase gaseosa) | d(X−X) / pm (fase sólida) |
|---|---|---|---|---|---|
 | |||||
 |
9. Toxicidad:
Los halógenos tienden a disminuir en toxicidad hacia los halógenos más pesados.
El gas de flúor es extremadamente tóxico: en concentraciones de 0.1 % es letal en minutos. El ácido hidrofluorhídrico también es tóxico: es capaz de penetrar la piel y causar quemaduras muy profundas y dolorosas. Además, los aniones de fluoruro son tóxicos aunque sin llegar a la toxicidad del flúor puro (el cual es letal alrededor de 5 a 10 gramos). Su consumo prolongado a concentraciones de 1.5 mg/L está asociado a la fluorosis dental, una anomalía en la cavidad oral. A concentraciones mayores a 4 mg/L aumenta el riesgo de desarrollar fluorosis ósea, endurecimiento de los huesos. Los niveles recomendados actualmente de floración del agua potable van de 0.7 a 1.2 mg/L para evitar efectos adversos del flúor sin desperdiciar sus beneficios. Personas con niveles entre los normales y los requeridos para desarrollar fluorosis ósea tienden a desarrollar síntomas parecidos a la artritis.
El gas de cloro es altamente tóxico. Al inhalarlo a concentraciones de 3 partes por millón ocurre una reacción tóxica de forma inmediata. Inhalarlo a 50 partes por millón es extremadamente peligroso y si se llega a inhalar a concentraciones de 500 partes por millón por tan solo unos cuantos minutos es letal. El ácido clorhídrico es un químico peligroso.
El bromo puro es algo tóxico pero menos que el flúor y el cloro. Cien miligramos de bromo son letales . Los aniones de bromo son letales, pero menos que el bromo el cual es letal en dosis de 30 gramos.
El yodo es relativamente tóxico, es capaz de irritar a los ojos y pulmones, con un límite de seguridad de 1 miligramo por metro cúbico. Cuando es ingerido de manera oral 3 gramos pueden ser letales. Sus iones son mayormente no tóxicos, pero pueden llegar a causar muerte al ser ingeridos en grandes cantidades.
El ástato es muy radiactivo y por ello muy peligroso.
Conclusión:
Este blog nos dejó claro cada uno de los integrantes de los grupos IV, V, VI, y VII; además de ésto nos enteramos de las propiedades químicas, físicas, los diferentes usos que se le puede dar a cada uno de los elementos y como se producen.
Webgrafía:
https://es.wikipedia.org/wiki/Grupo_del_Carbono
http://www.quimicaencasa.com/grupo-15-la-tabla-periodica-familia-del-nitrogeno/
http://www.quimicaencasa.com/grupo-16-la-tabla-periodica-familia-del-oxigeno/
https://es.wikipedia.org/wiki/Hal%C3%B3geno

BUEN TRABAJO4,5
ResponderEliminarJUEGO NO LE SALIO UNA IMAGEN 4,5
DEFINITIVA 4,5